Autorius:
Louise Ward
Kūrybos Data:
11 Vasario Mėn 2021
Atnaujinimo Data:
1 Liepos Mėn 2024

Turinys
Atomo dydis yra toks mažas, kad sunku tiksliai išmatuoti cheminio junginio atomo skaičių. Kad būtų galima tiksliai išmatuoti medžiagų kiekį, mokslininkai naudoja molio vienetą, nurodantį atomų skaičių. Vienas medžiagos molis apibrėžiamas kaip ekvivalentas anglies atomų skaičiui, esančiam 12 gramų 12 anglies izotopo, kuris yra apie 6022 x 10 atomų. Ši vertė vadinama Avogadro skaičiumi arba Avogadro konstanta. Tai dar vadinama atomų skaičiumi 1 molyje bet kurio elemento, o 1 molis medžiagos masės vadinamas tos medžiagos moline mase.
Žingsniai
1 metodas iš 2: apskaičiuokite elemento molinę masę
Molinės masės apibrėžimas. Molinė medžiagos masė yra vienos medžiagos molio masė (gramais). Norėdami apskaičiuoti elemento molinę masę, padauginkite jo atominę masę iš perskaičiavimo koeficiento gramais moliui (g / mol).
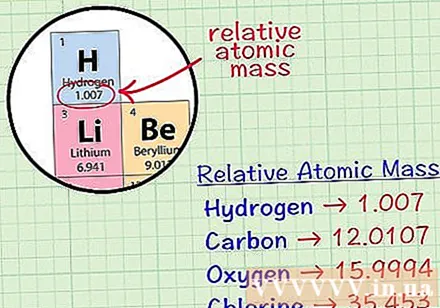
Raskite vidutinį kubinį elemento atomą. Vidutinė elemento masės atoma yra mėginio, kuriame yra visi to elemento izotopai, vidutinė masė atominiais vienetais. Ši informacija dažnai pateikiama periodinėje elementų lentelėje. Suradę elementą, galite rasti vidutinį kubinį atomą, parašytą tiesiai po elemento cheminiu simboliu. Ši reikšmė nėra sveikasis skaičius, bet skaičius su dešimtainiais skaičiais.- Pavyzdžiui, naudojant vandenilį, vidutinė masės atoma yra 1,007; Vidutinis anglies kubinis atomas yra 12,0107; Vidutinis deguonies masės atomas yra 15,9994; chloro vidutinė atominė masė yra 35 453.

Padauginkite vidutinę masės atomą iš molinės masės konstantos. Molinio tūptinės vienetas apibrėžiamas kaip 0,001 kilogramo moliui arba 1 gramo moliui. Vidutinės masės atomo ir molinės masės konstantos sandauga atomo masės vienetą paverčia gramais moliui, taigi vandenilio molinė masė bus 1,007 gramai moliui, anglies - 12. , 0107 gramai moliui, deguonies yra 15,9995 gramai molio, o chloro - 35 453 gramai molio.- Kai kurie elementai gamtoje egzistuoja kaip molekulės, susidedančios iš dviejų ar daugiau tų pačių atomų. Tai yra, jei norite apskaičiuoti junginių, sudarytų iš daugiau nei vieno atomo, pvz., Vandenilio dujų, deguonies dujų arba chloro dujų, molinę masę, turite nustatyti vidutinę junginio atominę masę ir padauginti šią vertę. esant molinei masės konstantai, „tada“ padauginkite ką tik rastą produktą iš 2.
- Su H2: 1007 x 2 = 2 014 gramų moliui; už O2: 15,9994 x 2 = 31,9988 g / mol; ir Cl2: 35 453 x 2 = 70 096 g / mol.
2 metodas iš 2: Apskaičiuokite junginio molinę masę

Nustatykite junginio struktūrinę formulę. Struktūrinė medžiagos formulė nurodo kiekvieno elemento, sudarančio tą junginį, atomo skaičių. (Ši informacija pateikiama visuose žinynuose). Pavyzdžiui, druskos rūgšties cheminė formulė yra HCl; gliukozės yra C6H12O6. Pagal šią struktūrinę formulę galime nustatyti kiekvieno atomo tipo, sudarančio nagrinėjamą junginį, skaičių.- Kur HCl turi vieną vandenilio atomą ir vieną chloro atomą.
- Gliukozės cukraus molekulė C6H12O6 turi 6 anglies atomus, 12 vandenilio ir 6 deguonies atomus.
Nustatykite kiekvieno sudedamojo elemento vidutinę masės atomą. Norėdami sužinoti vidutinę kiekvieno junginyje esančio elemento masės atomą, naudokite periodinę lentelę. Vidutinės masės atomas paprastai parašomas po elemento cheminiu simboliu periodinėje lentelėje. Panašiai kaip apskaičiuojant elemento molinę masę, vidutinę masės atomą padauginkite iš 1 gramo / mol.
- Druskos rūgštį sudarančių elementų vidutinis masės atomas yra toks: vandenilis 1,007 g / mol ir chloras 35,453 g / mol.
- Gliukozės molekulę sudarančių elementų vidutinis masės atomas yra: anglis, 12,017 g / mol; vandenilis, 1,007 g / mol; ir deguonies - 15,9995 g / mol.
Apskaičiuokite kiekvieno elemento molinę masę. Padauginus elemento masės atomą iš atomų skaičiaus, kurį jis sudaro junginyje, gaunama vidutinė elemento masė junginyje.
- Druskos rūgšties HCl atveju elemento vandenilio molinė masė yra 1,007 g / mol, o chloro - 35,453 g / mol.
- Gliukozės atveju C6H12O6kiekvieno elemento molinė masė yra tokia: anglis, 12,0107 x 6 = 72,0642 g / mol; vandenilis, 1007 x 12 = 12,084 g / mol; deguonis, 15,9995 x 6 = 95,9964 g / mol.
Bendra sudedamųjų elementų molinė masė Bendra kompostavimo elementų molinė masė yra junginio molinė masė.Ankstesniame etape mes apskaičiavome kiekvieno junginyje esančio elemento molinę masę, šiame etape mes tiesiog turime sudėti visas šias reikšmes.
- Molinė druskos rūgšties masė yra 1 007 + 35 453 = 36 460 g / mol. 36,46 gramo yra 1 mol druskos rūgšties masė.
- Molinė gliukozės masė yra 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. Taigi kiekvieno molio gliukozės masė yra 180,14 gramo.
Patarimas
- Nors daugeliu atvejų vidutinė masės atoma registruojama 1 000 tikslumu (4 skaitmenys po kablelio), laboratorijose molinė masė dažnai sumažinama iki 2 skaitmenų po kablelio, kartais net mažiau, didelėms molekulėms. Todėl laboratoriniu atveju druskos rūgšties molinė masė gali būti parašyta kaip 36,46 g / mol, gliukozei - 180,14 g / mol.
Ko tau reikia
- Cheminių medžiagų žinynas arba periodinė elementų lentelė
- Kompiuteris