Autorius:
Judy Howell
Kūrybos Data:
2 Liepos Mėn 2021
Atnaujinimo Data:
21 Birželio Birželio Mėn 2024

Turinys
- Žengti
- 1 dalis iš 2: atominio skaičiaus radimas
- 2 dalis iš 2: Susijusios informacijos paieška
- Patarimai
Elemento atominis skaičius yra protonų skaičius to elemento vieno atomo branduolyje. Elemento ar izotopo atominis skaičius nesikeičia, todėl naudodami atominį skaičių galite apskaičiuoti kitas elemento ar izotopo charakteristikas, pavyzdžiui, neutronų skaičių.
Žengti
1 dalis iš 2: atominio skaičiaus radimas
 Raskite periodinės lentelės kopiją. Čia galite rasti čia, jei neturite jo po ranka. Kiekvienas elementas turi skirtingą atominį skaičių, todėl nėra greitų ir lengvų metodų. Arba turėsite rasti periodinės lentelės kopiją arba ją įsiminti.
Raskite periodinės lentelės kopiją. Čia galite rasti čia, jei neturite jo po ranka. Kiekvienas elementas turi skirtingą atominį skaičių, todėl nėra greitų ir lengvų metodų. Arba turėsite rasti periodinės lentelės kopiją arba ją įsiminti. - Daugelyje chemijos vadovėlių viršelio vidinėje dalyje yra atspausdinta periodinė lentelė.
 Raskite elementą, kurį studijuojate. Daugumoje periodinių lentelių yra pilni įvairių elementų pavadinimai, taip pat jų cheminiai simboliai (pvz., Hg - gyvsidabris). Jei kyla problemų surandant elementą, internete ieškokite „cheminis simbolis“, po kurio nurodomas elemento pavadinimas.
Raskite elementą, kurį studijuojate. Daugumoje periodinių lentelių yra pilni įvairių elementų pavadinimai, taip pat jų cheminiai simboliai (pvz., Hg - gyvsidabris). Jei kyla problemų surandant elementą, internete ieškokite „cheminis simbolis“, po kurio nurodomas elemento pavadinimas.  Raskite atominį skaičių. Atomo numeris paprastai yra viršutiniame kairiajame arba dešiniajame langelio, kuriame yra elementas, kampe, tačiau jis taip pat gali būti kitur dėžutėje. Atomo skaičius visada yra sveikasis skaičius.
Raskite atominį skaičių. Atomo numeris paprastai yra viršutiniame kairiajame arba dešiniajame langelio, kuriame yra elementas, kampe, tačiau jis taip pat gali būti kitur dėžutėje. Atomo skaičius visada yra sveikasis skaičius. - Jei tai yra dešimtainis skaičius, tikriausiai žiūrite į atominę masę.
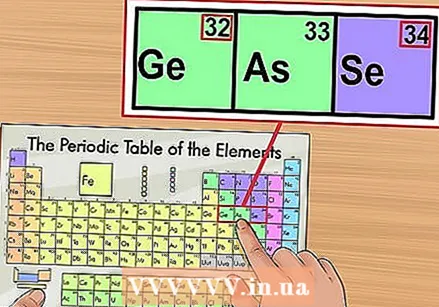 Patikrinkite, ar nėra gretimų elementų. Periodinė lentelė yra išdėstyta pagal atominį skaičių. Jei jūsų elemento atominis skaičius yra „33“, kairiajame elemente turėtų būti „32“, o dešinėje - „34“. Jei ši tvarka yra teisinga, jūs visiškai radote atominį skaičių.
Patikrinkite, ar nėra gretimų elementų. Periodinė lentelė yra išdėstyta pagal atominį skaičių. Jei jūsų elemento atominis skaičius yra „33“, kairiajame elemente turėtų būti „32“, o dešinėje - „34“. Jei ši tvarka yra teisinga, jūs visiškai radote atominį skaičių. - Po elementų 56 (baris) ir 88 (radis) gali būti tuščia vieta. Iš tikrųjų nėra vietos; ten priklausantys elementai su atomų skaičiais yra dviem eilėmis žemiau likusios sistemos. Vienintelė priežastis, dėl kurios jie yra taip atskirti, yra tai, kad periodinė lentelė yra mažiau plati.
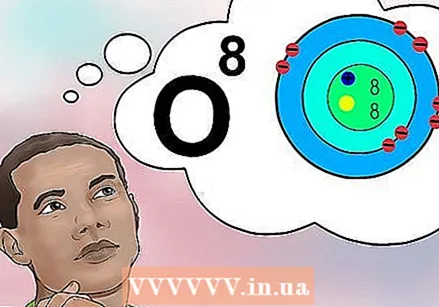 Supraskite, kas yra atominis skaičius. Yra paprastas elemento atominio skaičiaus apibrėžimas: protonų skaičius viename to elemento atome. Tai yra pagrindinis elemento apibrėžimas. Protonų skaičius lemia bendrą branduolio elektrinį krūvį, kuris nustato, kiek elektronų gali turėti atomas. Kadangi elektronai yra atsakingi už beveik visas chemines reakcijas, atominis skaičius netiesiogiai lemia beveik visas elemento fizines ir chemines savybes.
Supraskite, kas yra atominis skaičius. Yra paprastas elemento atominio skaičiaus apibrėžimas: protonų skaičius viename to elemento atome. Tai yra pagrindinis elemento apibrėžimas. Protonų skaičius lemia bendrą branduolio elektrinį krūvį, kuris nustato, kiek elektronų gali turėti atomas. Kadangi elektronai yra atsakingi už beveik visas chemines reakcijas, atominis skaičius netiesiogiai lemia beveik visas elemento fizines ir chemines savybes. - Kitaip tariant, kiekvienas atomas su aštuoniais protonais yra deguonies atomas. Du deguonies atomai gali turėti skirtingą neutronų skaičių arba (jei vienas yra jonas) skirtingą elektronų skaičių, tačiau abu visada turės aštuonis protonus.
2 dalis iš 2: Susijusios informacijos paieška
 Atominio svorio radimas. Atomo svoris periodinėje lentelėje paprastai spausdinamas atitinkamo elemento pavadinimu ir paprastai tiksliai apskaičiuojamas dviem ar trimis dešimtųjų tikslumu. Tai yra vieno atomo vidutinė elemento masė, pritaikyta tam, ką greičiausiai rasite gamtoje. Šis skaičius nurodomas „atominės masės vienetais“ (AMU (iš angl. „Atomic mass unit“)).
Atominio svorio radimas. Atomo svoris periodinėje lentelėje paprastai spausdinamas atitinkamo elemento pavadinimu ir paprastai tiksliai apskaičiuojamas dviem ar trimis dešimtųjų tikslumu. Tai yra vieno atomo vidutinė elemento masė, pritaikyta tam, ką greičiausiai rasite gamtoje. Šis skaičius nurodomas „atominės masės vienetais“ (AMU (iš angl. „Atomic mass unit“)). - Kai kurie mokslininkai vietoj „atominio svorio“ vartoja terminą „santykinė atominė masė“.
 Suprasti atominę masę. Atominė masė yra labai panaši į atominę masę. Vienintelis skirtumas yra tas, kad jūs kalbate ne apie tiriamojo mėginio vidurkį, o apie konkretų atomą. Grame geležies yra daug atomų, kurių masės šiek tiek skiriasi viena nuo kitos, todėl ieškokite „santykinio svorio“, kad rastumėte vidurkį. Jei jus domina tik vienas konkretus geležies atomas, jums nerūpi vidurkis - jus domina tik tiksli to konkretaus atomo masė.
Suprasti atominę masę. Atominė masė yra labai panaši į atominę masę. Vienintelis skirtumas yra tas, kad jūs kalbate ne apie tiriamojo mėginio vidurkį, o apie konkretų atomą. Grame geležies yra daug atomų, kurių masės šiek tiek skiriasi viena nuo kitos, todėl ieškokite „santykinio svorio“, kad rastumėte vidurkį. Jei jus domina tik vienas konkretus geležies atomas, jums nerūpi vidurkis - jus domina tik tiksli to konkretaus atomo masė. - Praktiškai atominė masė paprastai jau suteikiama chemijos problemoms, kurios susijusios tik su vienu atomu. Supraskite šią koncepciją, kad nenustebtumėte, jei ji skiriasi nuo atominės masės.
 Apvalus iki masės skaičiaus. Masės skaičius yra bendras protonų ir neutronų skaičius viename elemento atome. Šį skaičių galite lengvai rasti: tiesiog paimkite periodinėje lentelėje nurodytą atominį svorį ir suapvalinkite iki artimiausio sveiko skaičiaus.
Apvalus iki masės skaičiaus. Masės skaičius yra bendras protonų ir neutronų skaičius viename elemento atome. Šį skaičių galite lengvai rasti: tiesiog paimkite periodinėje lentelėje nurodytą atominį svorį ir suapvalinkite iki artimiausio sveiko skaičiaus. - Tai veikia, nes neutronai ir protonai yra maždaug 1 AMU, o elektronai yra arti 0 AMU. Dešimtainiam skaičiui gauti naudojami tikslūs atominio svorio matavimai, tačiau mus domina tik sveiki skaičiai, kurie nurodo protonų ir neutronų skaičių.
- Atminkite, kad naudojant atominę masę gausite tipinio mėginio vidurkį. Bromo mėginio masės skaičius yra apie 80, tačiau, kaip matyti, vieno bromo atomo masės skaičius beveik visada yra 79 arba 81.
 Apskaičiuokite neutronų skaičių. Dabar jūs žinote, kad atominis skaičius = protonų skaičius ir kad masės skaičius = protonų skaičius + neutronų skaičius. Norėdami sužinoti, kiek neutronų yra elemente, turite atimti atominį skaičių iš masės skaičiaus. Štai keli pavyzdžiai:
Apskaičiuokite neutronų skaičių. Dabar jūs žinote, kad atominis skaičius = protonų skaičius ir kad masės skaičius = protonų skaičius + neutronų skaičius. Norėdami sužinoti, kiek neutronų yra elemente, turite atimti atominį skaičių iš masės skaičiaus. Štai keli pavyzdžiai: - Vieno helio atomo (He) masės skaičius yra 4, o atomo - 2. Todėl jis turi būti 4 - 2 = 2 neutronai turėti.
- Sidabro mėginio (Ag) masės skaičius yra apie 108 (pagal periodinę lentelę), o atomo skaičius yra 47. Vidutiniškai kiekvieno mėginio sidabro atomo 108 - 47 = 61 neutronai.
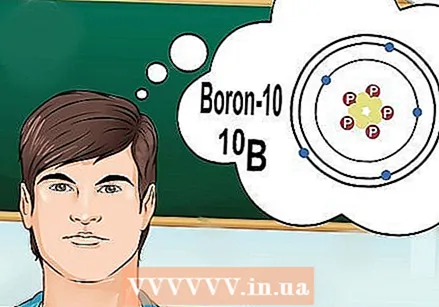 Supraskite, kas yra izotopai. Izotopas yra specifinė elemento, turinčio tam tikrą neutronų skaičių, forma. Kai chemijos klausimu kalbama apie „borą-10“ arba „B“, jie nurodo boro elementą, kurio masės skaičius yra 10. Naudokite šį masės skaičių vietoj „tipiškos“ boro vertės.
Supraskite, kas yra izotopai. Izotopas yra specifinė elemento, turinčio tam tikrą neutronų skaičių, forma. Kai chemijos klausimu kalbama apie „borą-10“ arba „B“, jie nurodo boro elementą, kurio masės skaičius yra 10. Naudokite šį masės skaičių vietoj „tipiškos“ boro vertės. - Izotopai neturi kitokio atominio skaičiaus. Kiekviename elemento izotope yra vienodas protonų skaičius.
Patarimai
- Kai kurių sunkesnių elementų atomo svoris yra uždarytas skliausteliuose arba skliaustuose. Tai reiškia, kad atominė masė yra tiksli stabiliausio izotopo masė, o ne kelių izotopų vidurkis. (Tai neturi įtakos elemento atominiam skaičiui.)